Noce Vomica
Tratto da “Piante Medicinali – Chimica, Farmacologia e Terapa” di R. Benigni, C. Capra e P.F.Cattorini
(Strychnos Nux Vomica L. – Fam. Loganiacee/Stricnee)
Noce Vomica- Ultimo aggiornamento pagina: 27/02/2018
Indice dei contenuti
- Generalità
- Componenti principali
- Proprietà farmacologiche
- Estratti e preparati vari
- Preparazioni usuali e Formule
- Bibliografia
Generalità

Etimologia – Strychnos, dal greco strufnos = amaro, acre, aspro.
Nux Vomica = noce (seme, mandorla) – vomica = che fa danno, male – velenosa.
Nomi volgari – Noce canina, fungo di Levante, vomiciaio, Canirum (Malabar), kuchila (beng. hind.), yetti (tam), mushti (tel.), cay chu chi (cocin.), fau mou pie, ma ts'ien tse eu (cin.).
Krahenaugen, Brechnuss (ted.), vomiting-nut, quaker buttons, dog buttons, poison-nut (ingl.), noix vomique (fr.), leuz alke (arab.), caniràn, matacà, mataperros (spagn.), nuz vomica (port.).
Habitat – India (Bengala, Malabar, Coromandel Coast), Ceylon, Isole dell’Arcipelago indiano, Cocincina, Siam, Malesia, Cina, Australia del nord.
Albero (sino a 15 m.).
Parti usate – I semi (Strychni semen F.U.).
Componenti principali
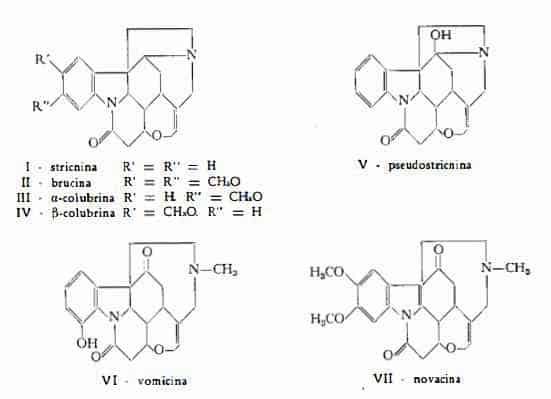
Gli alcaloidi stricnina e brucina, isolati da Pelletier e Caventou (1), a- e b-colubrina e pseudostricnina, trovati da Warnat (2), vomicina da Wieland e Oertel (3), novacina da Martin, Bentley, Henry e Spring (4).
Della stricnina e della brucina si è già trattato con la Fava di S. Ignazio.
Tra gli alcaloidi secondari della Noce vomica la pseudostricnina o ossistricnina, C21H22O3N2 (V), è stata estratta dalle acque madri ottenute dalla preparazione su larga scala della stricnina (2) (5). Gli alcaloidi minori a- e b-colubrina, C22H24O3N2, sono stati ricavati anch’essi, come la pseudostricnina, dalle acque madri derivanti dalla preparazione della stricnina (2). La vomicina, C22H24O4N2, è stata ottenuta dal Wieland (3) dai residui della preparazione della stricnina (3) (6). La novacina, C24H28O5N2, isolata dai residui ottenuti durante la purificazione del solfato di brucina, derivante dai semi di Noce vomica, è stata identificata alla N-metil-sec-pseudobrucina (4), ottenuta in precedenza da Leuchs e Tessmar (7).
Alla definizione delle formule di struttura degli alcaloidi secondari della Noce vomica hanno contribuito specialmente gli studi di Robinson e coll. (8) (9), di Leuchs e coll. (7) (10-12), di Friedmann (13), di Boit (14-20) e di Martin e coll. (4) per quanto riguarda la pseudostricnina e la novacina, le ricerche di Wieland, Huisgen e coll. (3) (21-24) per la vomicina, e gli studi di Warnat (2) e di Findlay (25) per la a- e la b-colubrina.
I semi di Strychnos Nux Vomica contengono in media 2-3% di alcaloidi totali, di cui circa il 50 % è costituito da stricnina ed il resto principalmente da brucina (26).
Nei semi di Noce vomica il contenuto di stricnina, secondo le prescrizioni del Cod. Gall. (27), deve essere almeno pari al 45% degli alcaloidi totali, secondo la Brit. Pharm. (28) e la Pharm. Intern. (29), deve essere al minimo di 1,2%, secondo il Nat. Formul. degli U.S.A. (30) deve essere di 1,15% dei semi.
Per il titolo di alcaloidi totali l’analisi di numerosi campioni ha messo in evidenza come valore più elevato 3,281 %, come valore minimo 0,199% (31). Schaefer (32) ha trovato dall’1,9 al 3,5% di alcaloidi totali, di cui 0,73-1,54% di stricnina e 1,12-2,23% di brucina: Eder e Ruckstuhl (33) hanno constatato un titolo di 2,4% per la somma degli alcaloidi e di 1,1 % ca. per la stricnina. Secondo Schaefer (34), nella quantità totale di alcaloidi la percentuale di stricnina oscillerebbe tra il 33 ed il 53%. Secondo Le Coultre e Wielen (35), vi sarebbe una proporzione inferiore di stricnina rispetto alla brucina. Il rapporto quantitativo tra stricnina e brucina sarebbe di 55:45 secondo Dufilho (36), in media di 44:56 secondo Morrison e Bliss (37). Negli alcaloidi totali di un campione di droga è risultato un contenuto di pseudostricnina pari a 0,8%, in un secondo campione un titolo dell'1,4% di pseudostricnina e del 2,8% di a- e b-colubrina (38).
Nei semi di Noce vomica sono stati inoltre identificati i seguenti componenti:
— il glucoside loganina, che per idrolisi produce glucosio e loganetina è stato trovato da Dunstan e Short (39) nei semi di Noce vomica, ma in quantità più elevate nella polpa del frutto della stessa pianta. Merz e Krebs (40) hanno isolato dalla polpa dei semi della Noce vomica 1,25-2% di loganina, cui hanno assegnato la formula grezza C17H26O10. Alle formule di struttura proposte precedentemente da Birch e Smith (41) e da Merz e Lehmann (42), più recentemente Sheth, Ramstad e Wolinsky (43) hanno sostituito la seguente:
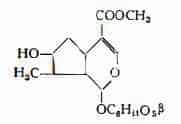
Loganina è stata trovata anche nella Menyanthes trifoliata L, (44) (45) e nella Fava di S. Ignazio. Sulla presenza della loganina nella Strychnos Ignatii Berg., si hanno referenze discordanti (46) (47).
– poliosi, composti da galattosio, mannosio, xilosio e arabinosio (all’incirca nei rapporti 5:2:1:1); un galattano costituito da catene di b-D-galattopiranosio (48).
– acido clorogenico (= acido igasurico) (49).
– olio grasso 2,5-4,2% con oleina 74,5%, gliceridi solidi 8,6% e frazione insaponificabile 16,9%. Nella frazione insaponificabile una fitosterina con p.f. 158°, due alcooli C32H54OH e C35H57OH (50). Nell’olio sono stati trovati gli acidi caprilico e caprico (51).
– stigmasterina (52).
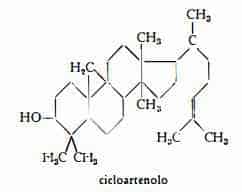
– l’alcool triterpenico cicloartenolo, C30H50O, è stato estratto dalla Noce vomica da Bentley, Henry, Irvine e Spring (53) ed è stato identificato dagli stessi AA. (53) e poi da Gonziles e Bréton (54) all’andianolo, ottenuto dal lattice di alcune specie di Euphorbia (E. handiensis, E. obtusifolia, E. balsamifera. E. aphyla).
– acqua 11,96% (33).
Le ceneri (1-3,5%) spesso contengono rame (50).
Proprietà farmacologiche ed impiego terapeutico
La corteccia dell’albero della Strychnos Nux Vomica era usata da tempo nella terapia indiana, ma i semi vennero conosciuti in Europa soltanto nel XV secolo.
L’azione farmacologica e terapeutica della Noce vomica è dovuta principalmente alla stricnina, la quale è contenuta in varia misura nelle diverse parti della pianta e, in percentuale maggiore, nel seme che è la parte della pianta considerata officinale.
I semi di Noce vomica sono impiegati in terapia come tali, sotto forma di polvere (rasura di Noce vomica) e sotto forma dei suoi preparati galenici (tintura, estratti fluido, molle, secco, titolati in stricnina).
Della stricnina vengono impiegati i suoi sali: il solfato e specialmente il nitrato perchè più stabile.
L’impiego della stricnina in terapia è piuttosto limitato e non si può dire che essa abbia, sotto questo aspetto, una notevole importanza. Maggior rilievo deve esserle invece attribuito dal punto di vista tossicologico e soprattutto per quanto riguarda il meccanismo di azione, argomento questo che essendo più o meno diffusamente svolto in tutti i testi di farmacologia, a noi non resta che il compito di riassumerlo schematicamente tenendo conto delle più recenti acquisizioni in proposito.
La sede principale dell’azione stricnica è il midollo spinale e comunemente si ritiene che essa si svolga sulle sinapsi per mezzo delle quali le fibre afferenti (sensitive) comunicano direttamente o indirettamente, tramite neuroni o cellule di associazione, con le cellule di origine delle fibre motrici.
Le sinapsi di tutte le vie di comunicazione intermedia, oppongono normalmente una certa resistenza alla propagazione degli impulsi afferenti o centripeti, atti a provocare un determinato riflesso. Se tale resistenza sinaptica mancasse, l’impulso si propagherebbe anche a catene di neuroni collaterali, determinando così la comparsa di più o meno numerose reazioni riflesse, oltre quella corrispondente a quel determinato impulso. Verrebbe così a mancare la localizzazione della reazione riflessa rispetto allo stimolo che l’ha provocata, localizzazione che è proprietà fondamentale delle reazioni di questo tipo.
Nell’estrinsecarsi di una qualsiasi reazione riflessa, la minor resistenza alla propagazione dell’eccitamento è data dalle vie che costituiscono l'arco diastaltico più breve perchè si manifesti il riflesso corrispondente ad un dato stimolo.
Soltanto stimoli molto intensi, possono vincere la resistenza di un certo numero di sinapsi più o meno lontane dal segmento midollare corrispondente alla regione stimolata.
L’azione della stricnina consisterebbe nell’abolire questa resistenza sinaptica, per cui un impulso centripeto, anche se di intensità minima, non percorre la via diastaltica più breve, che normalmente oppone la minima resistenza al suo passaggio, ma si irradia a numerose catene di neuroni associativi, determinando così, una risposta generalizzata anzichè localizzata, come normalmente avviene.
Secondo questa interpretazione, l’azione della stricnina non sarebbe quindi il risultato di una eccitazione dei neuroni motori ma, al contrario, di una inibizione della resistenza sinaptica al diffondersi degli impulsi centripeti, il che condurrebbe ad un aumento della velocità di scarica dei motoneuroni [Dusser de Barenne (55)].
Come ed attraverso quale intimo meccanismo avvenga questa inibizione, non è ancora definitivamente chiarito. Si ammette oggi che la trasmissione degli impulsi nervosi a livello delle sinapsi, avvenga per mezzo di un mediatore chimico che, anche in questo caso, sarebbe rappresentato dalla acetilcolina la quale, sotto l'azione degli impulsi centripeti, verrebbe normalmente liberata e rapidamente distrutta da un enzima specifico, la colinesterasi, determinando cosi una momentanea inibizione della resistenza sinaptica che facilita il passaggio dell’impulso lungo un determinato arco diastaltico. La stricnina inibendo la colinesterasi, determinerebbe un accumulo di acetilcolina e una sua più prolungata azione su tutte le sinapsi interessate, con conseguente aumento della velocità di scarica dell’impulso sui motoneuroni efferenti.
Questa interpretazione dell’azione stricnica, condurrebbe dunque ad ammettere che non solo la stricnina, ma tutte le sostanze dotate di azione inibente sulla colinesterasi e l'acetilcolina stessa, si comportino in maniera simile ad essa. Ma in realtà ciò non sempre avviene.
L’iniezione endovenosa di acetilcolina nel gatto cloralosato per es. deprime l'attività riflessa; l’eserina, sostanza dotata di elevata attività anticolinesterasica, esalta l’attività riflessa, mentre la prostigmina, altra sostanza ad attività anticolinesterasica, la deprime.
Si è tentato di spiegare questi fatti, ammettendo che il mediatore chimico, l'acetilcolina, possa indurre nella cellula sinaptica variazioni di stato di due tipi, tali cioè da originare uno stato eccitatorio o inibitorio a seconda che si venga a stabilire un aumento della sua concentrazione, rispettivamente, nell’interno della cellula o esternamente, sulla membrana delle terminazioni sinaptiche.
Secondo questa interpretazione, l’inibizione dell'attività riflessa determinata dall’iniezione endovenosa di acetilcolina, può essere spiegata ammettendo che con ciò si provochi un aumento extracellulare della concentrazione acetilcolinica e quindi aumento della resistenza al passaggio degli stimoli afferenti che non vengono scaricati sul neurone efferente.
L’eserina, composto nel quale la presenza di un N trivalente nella catena laterale, cui sembra essere legata l’attività anticolinesterasica, facilita la sua penetrazione nella cellula e provoca in essa un aumento della concentrazione acetilcolinica per inibizione dell’attività colinesterasica intracellulare: ne consegue una minor resistenza della sinapsi al passaggio degli impulsi ed esaltazione dei riflessi, sino a scatenare fatti convulsivi.
La prostigmina, composto nel quale l’atomo di N nella sua catena laterale è tetravalente, non penetra nella cellula ed esplica la sua azione inibente sulla colinesterasi extracellulare determinando una maggior concentrazione acetilcolinica in questa sede.
L’attitudine di penetrare o meno nella cellula sarebbe dunque data dal fatto che i sali dei composti ternari liberano per idrolisi prodotti liposolubili e quindi atti a penetrare attraverso la membrana cellulare lipoidea, ciò che non avviene per i sali dei composti quaternari che liberano prodotti idrosolubili.
Da ciò si dovrebbe dedurre che l’azione inibente la colinesterasi di cui è dotata la stricnina, composto nella cui molecola è presente un N ternario, si eserciti sulla colinesterasi intracellulare, determinando in questa sede una maggior concentrazione acetilcolinica.
Bradley e Eccles (56) in base ai risultati ottenuti dalle loro esperienze, ritengono o che la stricnina possa agire competitivamente per ridurre il deposito di una sostanza trasmettitrice inibitoria sulla membrana sinaptica e a questo proposito si ritiene che la stricnina possa deprimere con una azione molto simile a quella del curaro, l’azione dell’acetilcolina sia sulle giunzioni neuro-muscolari che sulle sinapsi gangliari: oppure che la stricnina interferisca con l’azione inibitoria, deprimendo per es., l’azione iperpo- larizzante della supposta sostanza trasmettitrice dell’azione inibitoria.
Gli AA. si chiedono come sia possibile spiegare l’azione convulsivante della stricnina unicamente in base alla sua azione deprimente sull’inibizione e formulano l’ipotesi che la depressione dell’azione inibitoria sugli interneuroni, determini un aumento molto appariscente dell’azione eccitatoria polisinaptica che è caratteristica del sistema nervoso stricnizzato.
Altri AA. hanno cercato di interpretare l’azione della stricnina in relazione ai suoi effetti periferici. Si è infatti osservato che la stricnina, a concentrazioni elevate, abolisce la risposta contrattile del muscolo stimolato direttamente, il che ha condotto alla conclusione che la stricnina agisca curarizzando le giunzioni neuro-muscolari e abolendo quindi la trasmissione a questo livello [Peugnet e Coppee (57), Bolly e Bacq (58)].
Più recentemente Eccles, Fatt e Koketsu (59) hanno dimostrato che la stricnina deprime l’inibizione ricorrente del midollo spinale e in questa sede esisterebbero, secondo questi AA., tre punti sui quali l’alcaloide potrebbe esplicare la sua azione: sull’assone o su una delle due cellule sinaptiche di Renshaw, una delle quali è colinergica.
Secondo gli AA. la stricnina agirebbe sulla sinapsi non colinergica ma le conclusioni di un recentissimo lavoro della Alving (60), tenderebbero invece a localizzare tale azione sulla sinapsi colinergica.
Questa A., basandosi sul fatto dimostrato precedentemente da Curtis e Eccles (61), che la giunzione neuro-muscolare e la sinapsi colinergica della via inibitrice ricorrente rispondono in modo simile alla stricnina, ha ripreso in esame il non ancora definitivamente risolto problema dell’azione di questo alcaloide sul sistema neuro-muscolare.
In realtà il fatto che la cellula sinaptica di Renshaw fosse insensibile all’azione dei composti quaternari, allorché questi vengano iniettati in circolo, fece sorgere dei dubbi sull'identità della risposta della giunzione neuro-muscolare e della cellula sinaptica di Renshaw agli agenti farmacologici. In seguito venne però accertato che questa insensibilità era dovuta ad una barriera che circonda la sinapsi centrale colinergica, del sistema di inibizione ricorrente, barriera che è relativamente impermeabile ai composti polari quali sono i composti quaternari. Ma questi, una volta penetrati nella barriera, determinano lo stesso effetto tanto sulla cellula sinaptica di Renshaw quanto sulla giunzione neuro-muscolare.
Così stando le cose, secondo la Alving, soltanto due possono essere le sedi di azione possibili della stricnina sulla via ricorrente inibitoria: o a livello della sinapsi collaterale — cellula colinergica di Renshauw o a livello della sinapsi, cellula non colinergica di Renshaw — motoneurone.
In base ai risultati delle sue ricerche ed a considerazioni dedotte da quelli ottenuti precedentemente da altri autori, la Alving crede di poter ragionevolmente arguire che la sede comune di azione della stricnina e di altri composti ad azione simile, non esclusa la tossina tetanica, sia rappresentata dalla sinapsi collaterale di natura colinergica — cellula di Renshaw, piuttosto che dalla cellula sinaptica non colinergica di Renshaw — motoneurone.
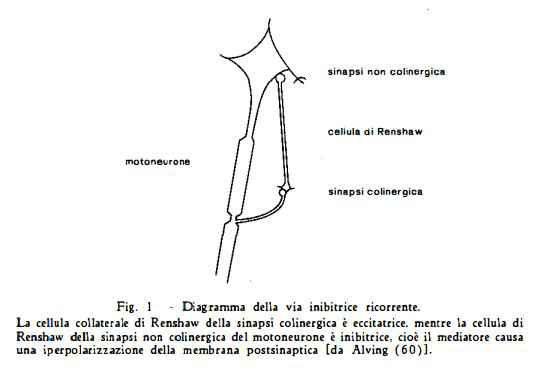
Sebbene i risultati ottenuti dalla Alving depongano a favore di questa ipotesi, non esisterebbe attualmente, secondo l’A. stessa, una prova sicura che precisi senza possibilità di dubbio, l’esatta sede dell'azione della stricnina e, pertanto, i risultati di queste ricerche dimostrano anche la necessità di un ulteriore studio volto a determinare la precisa localizzazione della azione della stricnina sulla via inibitoria ricorrente.
Sino a questo punto abbiamo trattato del meccanismo secondo il quale la stricnina può determinare una risposta riflessa più o meno intensa e generalizzata, all'azione di stimoli centripeti, anche se di intensità minima. Occorre aggiungere però, che la somministrazione di dosi sufficientemente elevate di questo alcaloide, provoca anche contrazioni spastiche dolorosissime di tipo tetanico, sul determinismo delle quali si continua ancora a discutere, non essendo stata ancora trovata per esse, una spiegazione che pienamente soddisfi.
Normalmente avviene che contemporaneamente alla contrazione di un muscolo si ha, per la legge dell’innervazione reciproca di Sherrington, la decontrazione, il rilasciamento del suo antagonista e sono appunto i neuroni intermedi che interrompono la conduzione verso l’antagonista allorché un muscolo venga stimolato alla contrazione. La stricnina abolirebbe questa interruzione, il che conduce alla contemporanea contrazione del muscolo stimolato e del suo antagonista, con conseguente contrazione spastica (tetano) da cui è caratterizzata appunto l’intossicazione stricnica. Ma il meccanismo secondo cui tale interruzione sinaptica avviene, non è stato ancora soddisfacentemente chiarito e le ipotesi formulate in proposito appaiono tuttora incomplete e pertanto insufficienti a fornire una esatta interpretazione di alcuni lati dell’azione stricnica.
Un ulteriore approfondimento di questo capitolo potrà derivare forse da un più attento studio dell'azione stricnica sulle diverse vie afferenti ed efferenti che costituiscono l'arco diastaltico e sugli impulsi motori e inibitori che ai centri spinali giungono dai centri superiori.
E’ oggi noto che l’arco diastaltico è costituito da fibre sensitive afferenti che, provenendo dalla regione equatoriale del fuso neuromuscolare, giungono alle corna posteriori del midollo spinale ed eccitano, connettendosi per via mono e polisinaptica, i neuroni motori nelle corna anteriori. Recentemente si è dimostrato che i neuroni motori che dalle corna anteriori giungono al fuso neuro-muscolare, sono di due tipi: alfa e gamma. Del primo tipo fanno parte due specie di motoneuroni: i neuroni tonici, attraverso i quali vengono portati gli impulsi che mantengono il tono muscolare e i neuroni fasici che conducono l'impulso motorio volontario o riflesso. Il secondo tipo è rappresentato dai neuroni gamma, la cui funzione è quella di portare stimoli continui alla parte contrattile del fuso neuromuscolare. Fra le proprietà dalle quali è caratterizzata la funzione di quest'ultimo, va annoverata anche e soprattutto, quella di poter proporzionare la sua sensibilità all’intensità degli stimoli dai quali viene sollecitato, mentre lo stato di contrazione delle sue miofibrille è condizionato dal numero degli impulsi che ad esso giungono dal midollo, seguendo la via afferente rappresentata dai motoneuroni gamma. L'attività di questi e il conseguente stato di contrazione del fuso, sono a loro volta determinati, oltre che dagli stimoli afferenti che giungono dalla periferia, anche da stimoli motori e inibitori provenienti dai centri superiori, quali il sistema reticolare di Moruzzi-Mogoun, il tratto piramidale, la corteccia cerebellare, il nucleo caudato, la corteccia motoria, che inviano stimoli motori ai motoneuroni gamma ai quali giungono invece impulsi inibitori dal centro inibitorio di Mogoun, dalla corteccia del culmen, dalla corteccia motoria, dalla corteccia orbitale e dal nucleo orbitale del talamo.
Oltre questa via lenta e già nota, per la quale gli stimoli vengono condotti e diffusi lungo il midollo, sino ai motoneuroni gamma, il Granit ne ha recentemente identificata un'altra, rapida e crociata, che scendendo dalla formazione reticolare del tronco encefalico, raggiunge i motoneuroni gamma.
Non si può escludere che la scoperta di questa nuova via di conduzione che, insieme con l'altra già nota, esplica la funzione di veicolare impulsi eccitanti e inibenti dai centri
Per quanto riguarda alcuni particolari aspetti dell’azione farmacologica della stricnina, ricorderemo che l’attività di essa sulla colinesterasi, secondo Vincent e Lagreu (63) è superiore a quella della brucina e che la colinesterasi cerebrale sarebbe più resistente all’azione di queste sostanze.
Bose e coll. (64) che sperimentarono comparativamente l’azione convulsivante di diversi sali di stricnina sulla rana, trovarono che il tartrato e il citrato sono più attivi del cloridrato.
Brosteanu e Brosteanu (65) notarono che la massima eccitabilità del preparato neuro-muscolare di rana la si ottiene con concentrazioni di stricnina di 10-7 e 10-3. Il K alla concentrazione di 10-6 e di 10-5 aumenterebbe gli effetti della stricnina i quali verrebbero invece diminuiti alla concentrazione di 10-7 ed annullati alla concentrazione di 10-3.
Reuse-Blom (66) ha studiato l’azione della stricnina su di un lembo parzialmente escisso dall'orecchietta del cuore isolato di coniglio ed ha osservato che essa inibisce l’attività del tessuto con cui viene posta direttamente in contatto, ma non ne altera la conduzione.
L’adrenalina ristabilisce temporaneamente l’attività inibita dalla stricnina, mentre l’acetilcolina resta senza effetto.
Impiego terapeutico – La Noce vomica sotto forma di rasura, ma soprattutto di tintura, viene frequentemente impiegata come amaro-tonico ed eupeptico, per il sapore intensamente amaro che i principi alcaloidei contenuti nella droga conferiscono alle sue preparazioni.
La stricnina, sotto forma dei suoi sali ha, come già detto, un impiego terapeutico molto limitato. Essa viene consigliata, ma sembra senza una sufficiente base farmacologica, come tonico muscolare, come stimolante della motilità gastroenterica, in alcune paralisi periferiche di origine tossica, reumatica o infettiva, per acuire la sensibilità sensoriale e specialmente visiva.
Sembra però che tali azioni si possano ottenere soltanto con dosi subtossiche. Più giustificato sembrerebbe il suo impiego come analettico respiratorio e nella terapia degli avvelenamenti da nervini depressori, ma anche in questi casi è preferibile l’uso di altri eccitanti meno tossici [Meneghetti (67)].
Tossicologia – La stricnina è nota come sostanza ad elevato coefficiente tossico e si considera che la dose letale per l’uomo adulto, può oscillare fra i 60 e i 100 mg. Avvelenamenti gravi si possono però verificare con dosi minori, comprese cioè fra i 15 e i 30 mg o anche a queste inferiori (5-10 mg) in individui particolarmente sensibili.
L’avvelenamento da stricnina e da droghe stricniche, è caratterizzato principalmente, da esaltazione dell’eccitabilità riflessa, da contrazioni muscolari spastiche, trisma, opistotono e tetano. La morte avviene per asfissia dovuta alla contrazione spastica dei muscoli respiratori.
La terapia dell’avvelenamento, nel caso in cui si possa intervenire rapidamente, quando cioè si presuma che la sostanza tossica sia ancora nello stomaco, consiste nel vuotamente di esso mediante lavanda gastrica. Si sconsigliano gli emetici i quali, per il protrarsi della loro azione anche durante il periodo convulsivo, potrebbero essere dannosi. Si somministrino quindi adsorbenti (carbone di Belloc o, meglio, i carboni attivati il cui potere adsorbente è molto superiore ), oppure una soluzione di permanganato o di joduri o anche di acido tannico.
Nel caso in cui l’assorbimento sia già avvenuto (ed è questo il caso più frequente, per la rapidità con cui i sali di stricnina vengono assorbiti), si instaurerà la terapia antagonistica, volta a limitare i fenomeni convulsivi ed a mantenere in efficienza la funzione respiratoria. L’intossicato da stricnina dovrà essere, prima di tutto, tenuto nella più completa tranquillità in maniera da evitare che stimoli di qualunque genere (visivi, acustici, tattili ecc.) possano provocare gli attacchi convulsivi.
Si somministrino quindi barbiturici per via endovenosa, meglio se per perfusione continua, sino ad ottenere un leggero effetto ipnotico. Se occorre si pratichi la respirazione artificiale, in maniera tale però da non provocare stimoli tali da aggravare lo stato convulsivo. L’intubazione può dare migliori risultati.
Nel caso in cui si rendesse necessario il vuotamento dello stomaco durante il periodo convulsivo, la lavanda gastrica deve essere eseguita sotto anestesia.
Per la terapia antagonista possono essere impiegati, oltre i barbiturici, anche altri farmaci quali il cloralio, la paraldeide ed anche gli anestetici generali quali l’etere e il cloroformio, sembra tuttavia che i risultati migliori si ottengano con i barbiturici.
Assorbimento ed eliminazione – La stricnina è assorbita molto rapidamente, ma la sua eliminazione avviene, almeno in parte, con una certa lentezza.
Circa 1/5 della dose somministrata, viene eliminata come tale attraverso l’emuntorio renale. La maggior parte viene eliminata entro le prime ore dopo la somministrazione e l’eliminazione può essere considerata completa dopo 2-3 giorni, anche se piccole quantità possono essere presenti nelle urine, ancora per 24-48 ore.
La parte che non viene così eliminata, è trasformata nel fegato in composti inattivi. Dato che la maggior parte della sostanza viene eliminata o trasformata molto rapidamente, i fenomeni dovuti ad eventuale accumulo possono essere praticamente esclusi, anche se qualche caso di intossicazione attribuito ad accumulo, sembra sia stato clinicamente osservato.
Estratti e preparati vari
a) Estratto fluido alcool-idrosolubile titolato al 2% di alcaloidi (g 1 = LV gtt).
Dosi: II-VI gtt 2-3 volte pro die.
b) Estratto fluido titolato al 2% di alcaloidi (g 1 = LV gtt).
Dosi: II-VI gtt 2-3 volte pro die.
c) Estratto molle acquoso titolato al 12% di alcaloidi.
Dosi: g 0,02-0,04 pro dose.
d) Estratto molle idroalcoolico titolato al 12% di alcaloidi.
Dosi: come sopra.
e) Estratto secco idroalcoolico F.U. titolato al 16 % di alcaloidi.
Dosi: g 0,01-0,03 pro dose.
f) Tintura: F.U. titolata allo 0,25% di alcaloidi.
Dosi: g 0,5-2 due-tre volte pro die.
Preparazioni usuali e formule galeniche
Tintura con titolo 0,25 % di alcaloidi
Estratto fluido noce vomica g 12,5
Alcool di 70°…………………………. g 87,5
(X-XXX gtt due-tre volte pro die).
Gocce digestive
Tinture noce vomica, anice, rabarbaro e colombo ana g 10
(X gtt prima dei pasti).
Pillole o confetti antianemici
Anidride arseniosa…………………………………………. g 0,002
Estratto secco noce vomica……………………………… g 0,01
Ferro ridotto……………………………………………………… g 0,1
Estratto molle tarassaco q. b. per 1 pillola o confetto
(2-3 pillole o confetti pro die).
Pillole o confetti nell'atonia intestinale
Estratto secco noce vomica……………………………. g 0,005
Estratto secco rabarbaro………………………………….. g 0,05
Estratto secco aloe…………………………………………… g 0,05
Per una pillola o confetto
(1-2 pillole o confetti alla sera).
BIBLIOGRAFIA
(1) PELLETIER e CAVENTOU, Ann. chini, et phys., S, 323, 1818; JO, 142, 1819 – (2) WARNAT K„ Helv. Chini. Acta, 14, 997, 1931 – (3) WIELAND H, e OERTEL G., Lieb. Ami.. 469, 193, 1929 – (4) MARTIN W. F„ BENTLEY H. R., HENRY J. A. e SPRING F. S., 1. Cheni. Soc., 3602, 1952 – (5) MANSKE R. H. F., The Alkaloids, voi. VI, 1960, p. 189 – (6) MANSKE R. H. F., The Alkaloids, voi. VI, 1960, pp. 195-204 – (7) LEUCHS H, e TESSMAR. Ber., 72, 965, 1939 – (8) ROBINSON e BLOUNT, ]. Cheni. Soc., 2305, 1932; Cheni. Zbl., II. 3410. 1932 • (9) ROBINSON, ANET e BAILEY, Cheni. Ind., 944, 1953; Chem. Abs„ 49, 346. 1955 – (10) LEUCHS, GRUNOW e TESSMAR, Ber., 70, 1701, 1937; Chem. Zbl., II. 2359, 1937 – (11) LEUCHS. Ber., 70, 2455. 1937; Chem. Zbl., I, 610, 1938 – (12) LEUCHS, Ber., 73, 731, 1940; Chem. Zbl., II, 1436, 1940 . (13) FRIEDMANN, J. Chem. Soc., 1585, 1950; Chem. Zbl., I, 1860, 1951 – (14) BOIT. Ber., S2, 303, 1949; Chem. Zbl., I, 2440, 1951 – (15) BOIT, Ber., SS. 217, 1950; Chem. Zhl., I. 2441, 1951 – (16) BOIT, Ber., S4, 923, 1951; Chem. Zbl., 1328, 1952 – (17) BOIT, Ber., SS, 19. 1952; Chem Zbl., 1329, 1952 – (18) BOIT, Ber., SS, 106, 1952; Chem. Zbl., 2674, 1952 – (19) BOIT e PAUL, Ber., S7, 1859, 1954; Chem. Zbl., 4351. 1955 – (20) BOIT e PAUL, Ber., SS. 697, 1955; Chem. Zbl., 8625, 1955 – (21) WIELAND e THIEL, Lieb. Ann., SSO, 287, 1942; Chem. Zbl., II. 1794, 1942 – (22) WIELAND e HUISGEN. Lieb. Ann., 555. 9. 1943; Chem. Zbl.. I, 15. 1944 – (23) WIELAND, HUISGEN e EDER, Lieb. Ann., S6I, 193, 1949; Chem. Zbl., Il, 1090, 1949 – (24) HUISGEN, EDER, BLAZEJEWICZ e MERGENTHALER, Ueb. Ann., 575, 121, 1951; Chem. Zbl., 2176, 1952 – (25) FINDLAY, J. Amer. Chem Soc., 73, 3008, 1951; Chem. Zhl., 2004, 1952 – (26) HENRY T. A., The Plani Alkaloids. IV ed., 1949, p. 553 – (27) Codex Medìcamenlarìus Gallicus, ed. VII, p, 518 – (28) British Pharmacopoeia, ed. 1958, p. 435 – (29) Pharmacopoeia Internationalis, ed. I, p. 228 – (30) National Formulary, XI ed„ 1960, p. 244 . (31) ROSENTHALER e WEBER, Disseti. Bern, 1920 – (32) SCHAEFER H„ Proc. NJ. Pharm. Assoc., 50, 1918 – (33) EDER R, e RUCKSTUHL O., Pharm. Acta Helv.. 19, 23. 1944 – (34) SCHAEFER H.. J.A.Ph.A., 687, 1918 – (35) LE COULTRE E. e WIELEN P.
V. d„ Pharm. IVeelcbl.. 75, 1329, 1938 – (36) DUFILHO E., Bai/, soc. pharm. Bordeaux, 65, 7, 222, 1927 . (37) MORRISON R. W. e BLISS A. R„ J.A.Ph.A.. 21, 648. 753, 1932 – (38) HOFFMANN-LA ROCHE F., cit. da EDER R. e RUCKSTUHL O., Pharm Acta Helv., 19, 23, 1944 – (39) DUNSTAN W. R, e SHORT F. W., Pharm J., 14, 1025, 1883 – (40) MERZ K. W. e KREBS K. G„ Arch. Pharm., 217, 1937 – (41) BIRCH A. J. e SMITH E., Australian 1. Chem., 9, 234, 1956 – (42) MERZ K. W. e LEHMANN H„ Arch. Pharm., 290. 543, 1957 – (43) SHETH K„ RAMSTAD E. e WOLINSKY J., Tetrahedron Letters, 39*. 1961 . (44) BRIDEL, J. pharm. chim.. 2. 165, 1910; 4, 49. 1911; 7, 529, 1913 – (45) ROSENTHALER L„ Schweiz. Ap. Ztg., 61, 31, 1923-(46) RANSON cit. da WEHMER C.. Die PDanzeiistolte, II ed., p. 964 – (47) FLUECKINGER, Arch. Pharm., 227, 145, 1889 – (48) ANDREWS P., HOUGH L. e JONES J. K. N., J. Chem. Soc.. 806, 1954; Chem. Abs., 49. 6842, 1955 – (49) GORTER K., Ueb. Ann., 379, 1911 – (50) WEHMER C, Die PDanzenstoffe, lì ed., p. 962 – (51) KARRER W, Konstitution und Vorkommen der organischen Pflanzcnstoffe, 1958. p, 290 – (52) Ibid., p. 859 – (53) BENTLEY H. R., HENRY 3. A., IRVINE D. S. e SPRING F. S., 3. Chem. Soc., 3673, 1953 – (54) GONZALES GONZALES A. e BRÉTON C., Anates reai soc. espan. fis. y quim. (Madrid). 49 B, 223, 1953; 51 B, 477, 1955; Chem. Abs., 4S, 7040 e, 1954; so, 7839 a, 1956 – (55) DUSSER DE BARENNE J. G., Physiol. Rev., 13. 325, 1953 – (56) BRADLEY K. e ECCLES C., Nature, 171, 1061, 1953 – (57) PEUGNET H. B. e COPPEE G. E„ Am. J. Physiol., 116. 120, 1936 . (58) BOLLY M. H. e BACO Z. M„ Comp. rend. soc. biol., 127, 1456, 1938 – (59) ECCLES J. C., FATT P. e KOKETSU K., 3. Physiol., 126. 524, 1954 – (60) ALVING B. 0„ Arch. intera, phar- macod. et de thér., 131, 123, 1961 – (61) CURTIS D. R. e ECCLES R. M-, 3. Physiol., 141, 435, 1958 – (62) BERGAMINI L. e SCHIFFER D„ Acta Neurol., 16 , 504, 1961 – (63) VINCENT D. e LAGREU R„ Comunicaz. alla Soc. de Phaimacle de Toulouse 13-1-1952; Ann. pharm. ìranc., 11, 321, 1953 – (64) BOSE B. C„ GUPTA S. S., VIJAYVARGIYA R. e JALNEVALLA K. M., Indian J. Med. Research, 46, 193. 1958; Chem. Abs., S2 , 994 a, 1958 – (65) BROSTEANU R. e BROSTEANU E. R„ Comunicaz. tU'Acad. Rep. Popolare Ramine, 6, 493, 1956; Chem. Abs., SI. 3840 a, 1957 – (66) REUSE-BLOM S., 3. Physiol., 48, 698, 1956; Chem. Abs., 51, 1459 h, 1957 – (67) MENEGHETTI E., Farmacologia, voi, I, p. 552, Cedam, Padova 1958.


